Monitorering af anti-osteoporotisk behandling
Udarbejdet af Michael Schønemann Rand, Niklas Rye Jørgensen, Peter Vestergaard, Bente Langdahl, Pernille Hermann og Torben Harsløf
Indledning
Der har været flere grunde til at nedsætte denne arbejdsgruppe. Brugen er knoglemarkører (KM) til monitorering af osteoporose er stigende og understøttes af en øget mængde evidens. Derudover er der i visse egne af landet en presset kapacitet på DXA.
Arbejdsgruppen er kommet med vejledning til mulig monitorering af osteoporosebehandling i bred forstand herunder både peroral og parenteral behandling og har i den forbindelse belyst anvendeligheden af hhv. KM (herunder både CTX og PINP) og DXA. I den forbindelse har vi vurderet den kliniske anvendelighed af begge modaliteter ift. at forudsige behandlingseffekt samt konsekvenserne af en måling der falder uden for det ønskede behandlingsmål.
Der kan generelt være 3 grunde til at monitorere:
- Vurdere adhærens
- Identificere non-respondere/behandlingssvigt
- Vurdere om et evt. behandlingsmål er opnået.
Ved antiresorptiv behandling kan behandlingssvigt defineres som følger:
- ≥ 2 lavenergifrakturer efter ≥ 12 mdrs behandling
- Fald i BMD på mere end least significant change (LSC, typisk > 3 % i columna eller >4-5 % i total hofte*)
- Manglende suppression af KM, hvor adhærens er sikret.
Behandlingssvigt bør føre til overvejelse om adhærens eller skift af behandling (se nedenfor).
*Måleusikkerhed afhænger af scanner og det betjenende personale og skal afklares lokalt
Monitorering af peroral behandling med bisfosfonater
Op imod 40 % af patienter som påbegynder peroral bisfosfonat, ophører med behandlingen inden for år [1], og biotilgængeligheden af behandlingen, som i forvejen er meget lav (0,7 %), nedsættes med op til 80%, hvis medicinen ikke indtages efter forskrifterne [2].
Knoglemarkører
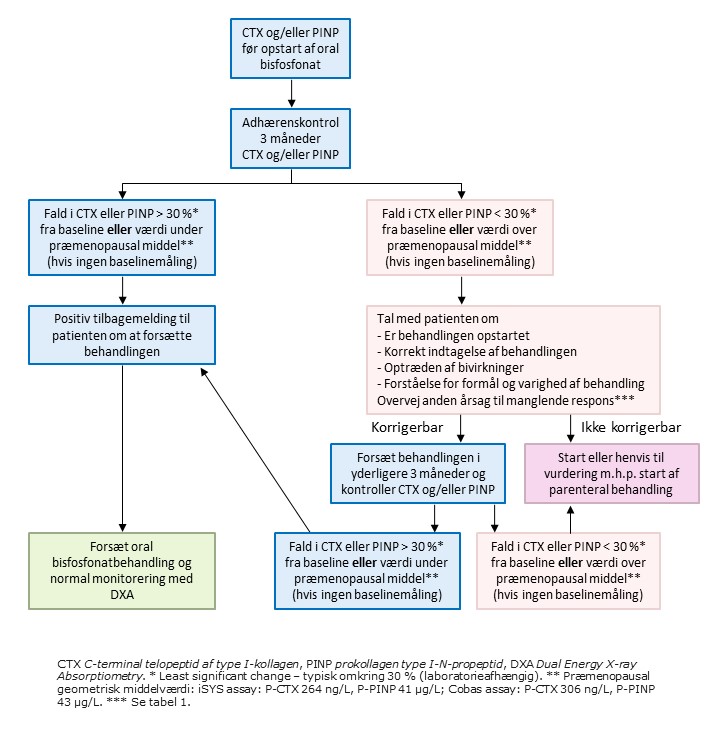
Knogleresorptionsmarkøren C-terminale telopeptid cross links (CTX) og knogleformationsmarkøren procollagen type I N-terminale polypeptid (PINP), målt i serum eller plasma, kan anvendes til at monitorere adhærens til oral bisfosfonatbehandling (figur 1) [3]. Bemærk, at målingen af CTX bør ske fastende (se også tabel 1) mellem kl 7.30 og 10.00. For at kunne anvende og fortolke KM korrekt er det vigtigt at have kendskab til faktorer, som foruden osteoporosebehandling har betydning for KM-niveauet. De væsentligste faktorer som bidrager til præanalytisk variation er præsenteret i tabel 1.
Knoglemarkørerne kan måles umiddelbart før behandlingsopstart samt efter tre måneders behandling. En reduktion i CTX og/eller PINP ≥ LSC, som typisk er omkring 30 %, indikerer behandlingsrespons/god adhærens [3]. Hvis KM ikke er blevet målt forud for behandlingsopstart, kan behandlingsmålet efter 3/6 måneders behandling for både mænd og kvinder være et CTX eller PINP-niveau < det geometriske gennemsnit for præmenopausale kvinder [3], dvs. CTX under 264 ng/L og 306 ng/L ved brug af hhv. iSYS- og Cobas assay og PINP under 41 μg/L og 43 μg/L ved brug af hhv. iSYS- og Cobas assay [4]. Dog er denne monitoreringsmetode formentlig mere usikker end monitorering via ændring fra baseline.
Hvis osteoporosebehandling opstartes indenfor de første 6 måneder efter en fraktur, er det usikkert at vurdere behandlingsrespons/adhærens ud fra ændringer i knoglemarkørerne, da disse stiger efter en fraktur. I stedet kan måles efter ét år efter frakturen og behandlingsmålet vil være som i tilfælde hvor der ikke foreligger baseline måling.
Manglende behandlingsrespons skyldes hyppigst adhærensproblemer[5]. Det Fælles Medicinkort kan anvendes til at vurdere adhærens via indløste recepter, men giver ikke information om, hvorvidt patienten er påbegyndt indtagelse af medicinen og indtager denne korrekt. Patienten bør vejledes og støttes på individuel basis i forhold til non-adhærens samt håndtering af eventuelt udløsende faktorer (f.eks. bivirkninger). Hos få individer ses først et fald i knoglemarkørerne ≥ LSC efter 6 måneders behandling [5]. Ved manglende respons efter 3 måneders behandling trods angivet god adhærens, anbefales det at opmuntre patienten til forsat behandling og måle KM yderligere 3 måneder.
Hvis det ved 3 eller 6 måneders kontrollen vurderes, at det ikke er muligt at bedre behandlingsresponset kan omlægges til parenteral behandling (denosumab eller zoledronsyre), om end alendronat som brusetablet kan forsøges, hvis adhærensproblemer skyldes gastro-intestinale bivirkninger [6]. Ved mistanke om adhærensproblemer senere i behandlingsforløbet, kan KM-måling gentages for at sikre, at disse fortsat er supprimerede. Hvis der ikke er adgang til at få målt KM, anbefales det, at der på anden vis følges op på patientens adhærens efter 1-3 måneders behandling (f.eks. ambulant/telefonisk samtale).
BMD
Der afventes fortsat studier der viser, om KM-monitorering i nogle tilfælde kan erstatte BMD-monitorering. BMD-monitorering kan typisk foretages efter 2-5 års peroral behandling efter individuel vurdering og afhængig af om der anvendes KM. Reskanning bør om muligt foretages på den samme skanner, da målinger af BMD på forskellige skannere ikke er sammenlignelige med mindre der er foretaget krydskalibrering.
Fald i BMD > LSC (typisk > 3 % i columna eller >4 % i total hofte) defineres som behandlingssvigt [7]. I tilfælde af behandlingssvigt skal fokus rettes imod adherenceproblemer og sekundære årsager til manglende respons. Omlægning til parenteral behandling kan overvejes.
Figur 1 – algoritme til monitorering af adhærens med KM til oral bisfosfonat.
Tabel 1 – Væsentlige faktorer som bidrager til knoglemarkørnes præanalytiske varians [8–10]
Faktor Betydning Håndtering Kontrollerbare faktorer Døgnrytme CTX er højst den sidste halvdel af natten/tidlig morgen og lavest om eftermiddagen. Ikke vigtig for PINP. Mål CTX mellem kl. 07.30 og 10.00 eller anvend PINP Fødeindtag CTX falder efter fødeindtag. Ikke vigtig for PINP. Mål fastende CTX eller anvend PINP Motion Akutte og kroniske effekter. Effekten afhænger af typen af motion og patientens alder. Undgå træning 24 timer optil blodprøvetagning Ukontrollerbare faktorer Menopausal status KM stiger indenfor få måneder efter den sidste menstruation. Anvendelsen af KM til monitorering bør undgås hos kvinder i klimakteriet Frakturer KM kan være eleveret et år efter en fraktur. CTX og PINP er typisk nær udgangspunktet 6 måneder efter frakturen. Ved frakturer indenfor 6 måneder op til behandlingsopstart: Mål KM ét år efter frakturen. Behandlingsmålet er KM < det geometriske gennemsnit for præmenopausale kvinder Medicin Betydende effekt af blandt andet glukokortikoid-, anti-epileptika-, anti-østrogen- og anti-adrogenbehandling på KM. KM kan både stige og falde afhængig af den anvendte medicin Opmærksomhed på indvirkning af andet medicin på KM (specielt ved nyopstart eller dosisændring). Ved glukokortikoid behandling anvendes CTX. Sygdomme Betydende effekt ved eksempelvis stofskiftelidelse, svær d-vitamin mangel, primær hyperparatyroidisme, diabetes og svær nyreinsufficiens (eGFR<30 mL/min/1,73), inflammatorisk sygdom Opmærksomhed på ubehandlet/dysreguleret sygdoms effekt på KM Immobilitet CTX stiger og PINP falder Opmærksomhed på (nyopstået) immobilitets effekt på KM
Monitorering af behandlingspause ved peroral bisfosfonat
Efter 5 års behandling med bisfosfonat kan overvejes pause hos patienter hvor [11, 12]:
- T-score i hoften > -2,5
- Der ikke har været frakturer i behandlingsperioden
- Der aldrig har været sammenfald eller hoftebrud
Behandling i mere end 5 år er dog mere effektivt i forhold til frakturforebyggelse end at holde pause [11].
Ét argument for at indlede behandlingspause kan være at undgå langtidsbivirkninger som atypisk femurfraktur og kæbenekrose. Ift. atypisk femurfraktur er risikoen for disse mindre end behandlingsgevinsten selv ved behandling > 5 år [13] og falder mod udgangsværdien efter to års pause [14]. Ift. kæbenekrose stiger risikoen med behandlingsvarigheden, men er langt under risikoen for knoglebrud [15].
Få studier har belyst værdien af monitorering med hhv. DXA og KM. På gruppeniveau gælder, at jo større stigning i KM under pause jo større fald i BMD [16]. På individniveau kan dog ikke findes et cut-off og et dansk ”real-life” studie viste, at allerede ved indledning af behandlingspause havde over 1/3 af patienterne KM værdier over geometrisk mean og dette steg til 80% efter 12 mdr [16]. Resultatet kan tale for manglende adhærens under behandlingen, og behandlingspause bør kun indledes i tilfælde hvor man ved, at adhærensen har været god.
Stigning eller fald i hhv. KM eller BMD udover LSC under behandlingspause må antages at være udtryk for aftagende effekt, hvorfor ændring efter 12-24 mdr bør lede til genoptag af behandlingen.
Alternativt kan monitorering under pause udelades og behandlingen kan genoptages efter 2 år hvor bivirkningsprofilen igen er gunstig.
Monitorering af parenteral behandling
Ved parenteral behandling med denosumab og zoledronsyre er vurdering af adhærens irrelevant, hvorfor monitorering skal bruges til at identificere behandlingssvigt jf. definition ovenfor og evaluere behandlingsmål eller -svigt.
Ved parenteral behandling med teriparatid eller romosozumab bør monitorering også adressere adhærens.
Zoledronsyre
Zoledronsyre er sjældent førstevalgsbehandling men bruges oftest ved intolerans overfor alendronat, eller efter anabol behandling. Zoledronsyre adhærerer stærkt til knoglevæv, hvorfor der er evidens for, at visse patienter kan holde behandlingspause efter 3 års behandling [17]. Kriterierne for behandlingspause vil typisk være [18]:
- T-score > -2,5 i hoften
- Ingen sammenfald eller hoftebrud
- Ingen lavenergifrakturer i behandlingsperioden
Derudover vil en overvejelse om behandlingspause typisk også forudsætte at patienten ikke er non-responder. Hos ptt. hvor behandling skal fortsættes i mere end 3 år anbefales minimum 6 års behandling[17].
Med baggrund i ovenstående anbefales det allerede inden behandlingsopstart at vurdere, om behandlingspause efter 3 år kan blive en mulighed.
- Hos ptt. hvor pause efter 3 års behandling er en mulighed anbefales kontrol –DXA efter 3 år for at vurdere om behandlingsmålet (T-score > -2,5 i hoften er nået).
- Hos ptt. hvor pause efter 3 år på forhånd ikke er en mulighed (fx patient med sammenfald) foreslås DXA efter 2 år for at se om patienten er non-responder. Er der behandlingsrespons anbefales ny DXA efter yderligere 4 år mhp vurdering af evt. behandlingspause.
- Der er evidens for, at den bedste måde at forudsige behandlingsrespons ved zoledronsyre er 1-års ændring i P1NP [19], men dette gælder kun for behandlingsnaive patienter, som i Danmark er et fåtal.
Der foreligger ikke studier om monitorering af behandlingspause med zoledronsyre, men compliance er kendt og påvirker ikke de målinger, man vil kunne monitorere med. Med baggrund i den lange virkningsvarighed af zoledronsyre foreslås DXA eller KM efter 2-3 års pause og genoptagelse ved ændringer > LSC.
Denosumab
Denosumab er sjældent førstevalgsbehandling og gives i reglen ved intolerans over for alendronat eller behandlingssvigt ved dette. Denosumab er mere potent til at supprimere knogleomsætningen end bisfosfonater [20] og giver ved lang tids behandling (>3 år) også større stigninger i BMD [21]. Denosumab er et antistof, der cleares fuldstændigt efter 6 måneder, hvorefter effekten stopper, og BMD begynder at falde mod patientens eget udgangsniveau [22]. Behandling med denosumab er derfor enten livslang eller skal efterfølges af anden antiresorptiv behandling, som ofte vil være zoledronsyre. Skift til zoledronsyre vil dog i reglen medføre et mindre tab af BMD [23]. Manglende respons på denosumab behandling er vil med baggrund i ovenstående i reglen ikke kunne føre til skift til anden behandling. Af den grund er formålet med monitorering af denosumab behandling primært at vurdere om patienten har nået et BMD niveau, der retfærdiggør skift til zoledronsyre og dermed senere behandlingspause. Skift til zoledronsyre vil typisk være relevant ved bivirkninger eller hvis T-score i hoften er > -2 – -1,5 [24]. Med baggrund i ovenstående forslås første DXA-kontrol 3-5 år efter behandlingsstart og derefter efter individuel vurdering.
Teriparatid
Teriparatid er en anabol behandling hvilket afspejles i stigende knogleformationsmarkører under behandling. Teriparatid er en reversibel behandling og skal følges op af antiresorptiv behandling.
Under teriparatidbehandling har PINP det højeste signal-støj forhold af alle formationsmarkører. PINP stiger signifikant efter 1 måned og når sit toppunkt ca. 6 mdr efter behandlingsstart uanset om patienten er behandlingsnaiv eller ej eller får glukokortikoider. Der er en stærk korrelation mellem stigning i PINP ved 1 måned og 12 måneders stigning i BMD i lænden. En stigning i PINP på 10 µg/L på 1 måned kan diskriminere adherente fra non-adherente ptt. med en falsk positiv rate på kun 3% uanset tidligere antiresorptiv behandling [25]. Med baggrund i ovenstående foreslås som monitorering af behandlingsrespons kontrol af PINP ved baseline samt efter 1 måned med evt. gentagelse efter 3 måneder ved manglende respons (se figur). Derudover DXA-scanning efter endt behandling og før opstart af antiresorptiv behandling.
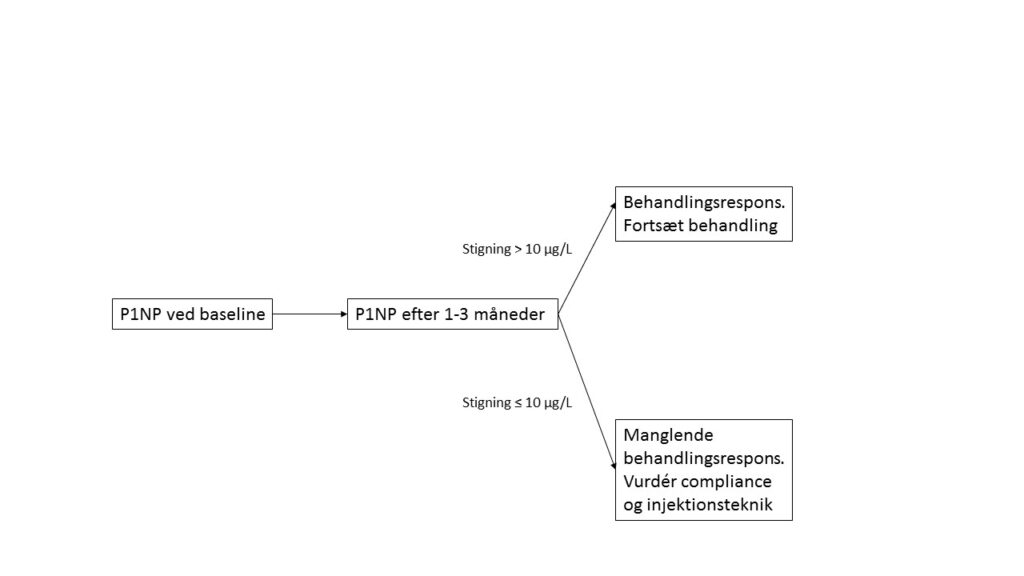
Hos individer hvor der er god adhærens men manglende PINP respons anbefales ikke behandlingsskift da disse patienter på gruppeniveau har en stigning i BMD, som dog er mindre.
Romosozumab
Romosozumab er en dual-action behandling, der både stimulerer knogleopbygning og hæmmer knoglenedbrydning. Behandlingen er reversibel og skal efterfølges af anti-resorptiv medicinsk behandling. Der findes ikke data på brugen af knoglemarkører under behandling til vurdering af adhærens eller effekt men efter endt behandling og før opstart af antiresorptiv behandling foreslås DXA.
Referencer
1. Pedersen AB, Risbo N, Kafatos G, et al (2023) Utilization patterns and factors associated with persistence of new users of anti-osteoporosis treatment in Denmark: a population-based cohort study. Arch Osteoporos. doi: 10.1007/s11657-023-01210-4
2. Lin JH (1996) Bisphosphonates: A review of their pharmacokinetic properties. Bone 18:75–85. doi: 10.1016/8756-3282(95)00445-9
3. Diez-Perez A, Naylor KE, Abrahamsen B, et al (2017) International Osteoporosis Foundation and European Calcified Tissue Society Working Group. Recommendations for the screening of adherence to oral bisphosphonates. Osteoporos Int 28:767–774. doi: 10.1007/s00198-017-3906-6
4. Jørgensen NR, Møllehave LT, Hansen YBL, et al (2017) Comparison of two automated assays of BTM (CTX and P1NP) and reference intervals in a Danish population. Osteoporos Int 28:2103–2113. doi: 10.1007/s00198-017-4026-z
5. Naylor KE, Jacques RM, Paggiosi M, et al (2016) Response of bone turnover markers to three oral bisphosphonate therapies in postmenopausal osteoporosis: the TRIO study. Osteoporos Int 27:21–31. doi: 10.1007/s00198-015-3145-7
6. Fuggle N, Al-Daghri N, Bock O, et al (2022) Novel formulations of oral bisphosphonates in the treatment of osteoporosis. Aging Clin Exp Res 34:2625–2634. doi: 10.1007/s40520-022-02272-z
7. Diez-Perez A, Adachi JD, Agnusdei D, et al (2012) Treatment failure in osteoporosis. Osteoporos Int 23:2769–2774. doi: 10.1007/s00198-012-2093-8
8. Vasikaran S, Eastell R, Bruyère O, et al (2011) Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: A need for international reference standards. Osteoporos Int 22:391–420. doi: 10.1007/s00198-010-1501-1
9. Szulc P, Naylor K, Hoyle NR, et al (2017) Use of CTX-I and PINP as bone turnover markers: National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability. Osteoporos Int 28:2541–2556. doi: 10.1007/s00198-017-4082-4
10. Schini M, Vilaca T, Gossiel F, et al (2023) Bone Turnover Markers: Basic Biology to Clinical Applications. Endocr Rev 44:417–473. doi: 10.1210/endrev/bnac031
11. Black DM, Schwartz A V., Ensrud KE, et al (2006) Effects of continuing or stopping alendronate after 5 years of treatment: The Fracture Intervention Trial long-term extension (FLEX): A randomized trial. JAMA 296:2927–2938. doi: 10.1001/jama.296.24.2927
12. Schwartz A V, Bauer DC, Cummings SR, et al (2010) Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res 25:976–82. doi: 10.1002/jbmr.11
13. Abrahamsen B, Eiken P, Prieto-Alhambra D, Eastell R (2016) Risk of hip, subtrochanteric, and femoral shaft fractures among mid and long term users of alendronate: Nationwide cohort and nested case-control study. BMJ. doi: 10.1136/bmj.i3365
14. Black DM, Geiger EJ, Eastell R, et al (2020) Atypical Femur Fracture Risk versus Fragility Fracture Prevention with Bisphosphonates. N Engl J Med 383:743–753. doi: 10.1056/nejmoa1916525
15. Ishimaru M, Ono S, Morita K, et al (2022) Prevalence, Incidence Rate, and Risk Factors of Medication-Related Osteonecrosis of the Jaw in Patients With Osteoporosis and Cancer: A Nationwide Population-Based Study in Japan. J Oral Maxillofac Surg 80:714–727. doi: 10.1016/j.joms.2021.12.007
16. Sølling AS, Harsløf T, Bruun NH, Langdahl B (2021) The predictive value of bone turnover markers during discontinuation of alendronate: the PROSA study. Osteoporos Int 32:1557–1566. doi: 10.1007/s00198-021-05835-4
17. Black DM, Reid IR, Boonen S, et al (2012) The effect of 3 versus 6 years of Zoledronic acid treatment of osteoporosis: A randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res 27:243–254.
18. Cosman F, Cauley JA, Eastell R, et al (2014) Reassessment of fracture risk in women after 3 years of treatment with zoledronic acid: When is it reasonable to discontinue treatment? J Clin Endocrinol Metab 99:4546–4554. doi: 10.1210/jc.2014-1971
19. Mattia L, Davis S, Mark-Wagstaff C, et al (2022) Utility of PINP to monitor osteoporosis treatment in primary care, the POSE study (PINP and Osteoporosis in Sheffield Evaluation). Bone. doi: 10.1016/j.bone.2022.116347
20. Brown JP, Prince RL, Deal C, et al (2009) Comparison of the effect of denosumab and alendronate on BMD and biochemical markers of bone turnover in postmenopausal women with low bone mass: A randomized, blinded, phase 3 trial. J Bone Miner Res 24:153–161. doi: 10.1359/jbmr.0809010
21. Papapoulos S, Chapurlat R, Libanati C, et al (2012) Five years of denosumab exposure in women with postmenopausal osteoporosis: Results from the first two years of the FREEDOM extension. J Bone Miner Res 27:694–701. doi: 10.1002/jbmr.1479
22. Miller PD, Bolognese MA, Lewiecki EM, et al (2008) Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: A randomized blinded phase 2 clinical trial. Bone 43:222–229. doi: 10.1016/j.bone.2008.04.007
23. Sølling AS, Harsløf T, Langdahl B (2020) Treatment with Zoledronate Subsequent to Denosumab in Osteoporosis: a Randomized Trial. J Bone Miner Res 35:1858–1870. doi: 10.1002/jbmr.4098
24. Ferrari S, Libanati C, Lin CJF, et al (2019) Relationship Between Bone Mineral Density T-Score and Nonvertebral Fracture Risk Over 10 Years of Denosumab Treatment. J Bone Miner Res 34:1033–1040. doi: 10.1002/jbmr.3722
25. Krege JH, Lane NE, Harris JM, Miller PD (2014) PINP as a biological response marker during teriparatide treatment for osteoporosis. Osteoporos Int 25:2159–2171. doi: 10.1007/s00198-014-2646-0
