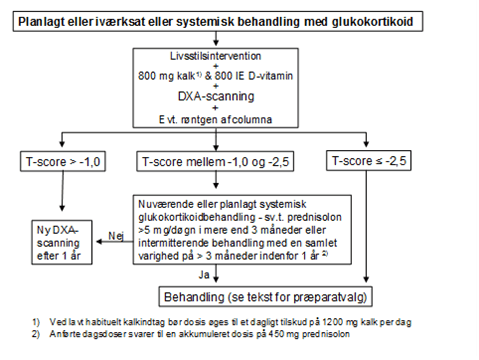
Farmakologisk behandling anvendes som sekundær og tertiær frakturprofylakse. Formålet med behandling er at forebygge frakturer hos individer med en øget frakturrisiko (sekundær profylakse) såvel som at forebygge yderligere frakturer hos personer, som allerede har pådraget sig en fraktur (tertiær profylakse). I tillæg til den farmakologiske behandling bør de anførte non-farmakologiske behandlingsprincipper også anvendes til denne gruppe af patienter.
Traditionelt opdeles lægemidler, som anvendes til behandling af osteoporose, i antiresorptive og knogleanabole midler. I den sammenhæng regnes behandling med PTH/PTH-analoger for en egentlig knogleanabol behandling, mens de øvrige lægemidler anses for primært at virke antiresorptivt, om end spørgsmålet om en evt. svag anabol effekt for strontium fortsat er uafklaret. Ved knogleanabol behandling stimuleres knogleformationen således, at der opstår en positiv balance per remodelleringscyklus eller de novo-knoglenydannelse (Afsnit 2.1). Ved antiresorptiv behandling hæmmes osteoklastaktiviteten, hvorved aktiveringsfrekvensen – og dermed remodeleringsrummet – mindskes. Hos ældre, hvor knogleresorptionen overstiger formationen og hvor der er stor risiko for tab af trabekler, fører dette tillige til et mindsket aldersbetinget knogletab.
I faktaboks 6 er anført indikation, virkningsmekanisme samt forhold af særlig betydning for lægemidler der anvendes til behandling af osteoporose. For en detaljeret beskrivelse, herunder af mulige bivirkninger henvises til lægemiddelkataloget samt produktresuméerne for de pågældende midler.
Faktaboks 6. Farmakologisk behandling – særligeforholdsregler

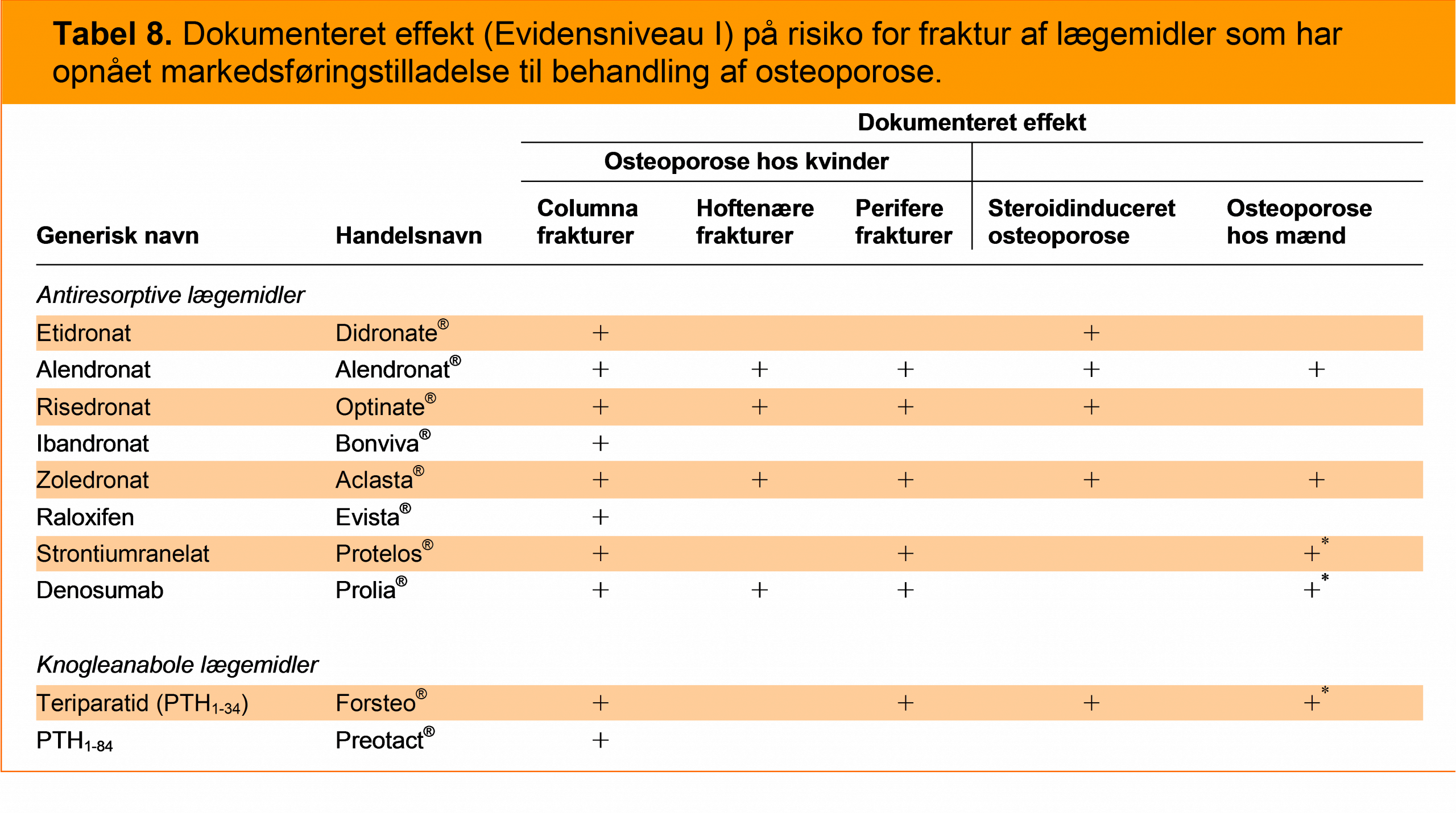
Bisfosfonater har dokumenteret effekt ved behandling af postmenopausal og senil osteoporose, om end graden af dokumentation varierer præparaterne imellem (1;2). I Tabel 8 er anført de præparater, som har opnået markedsføringstilladelse i Danmark med angivelse af dokumenteret effekt på forskellige typer af frakturer (Evidensniveau I). Nogle af præparaterne anvendes kun som i.v.-infusion (zoledronat og pamidronat), ibandronat kan administreres både som i.v.-infusion og peroralt, mens etidronat, alendronat, og risedronat kun administreres peroralt. Flere af præparaterne er vist at kunne forebygge frakturer hos mænd (alendronat og zoledronat) og ved glukokortikoidinduceret osteoporose (risedronat, alendronat og etidronat). Der er dokumenteret en reduceret mortalitet hos patienter med hoftenære frakturer behandlet med zoledronat (3).
Effekter på BMD
Behandlingen forårsager en stigning i BMD, som typisk andrager 5-9% i columna lumbalis og 2-6% i hofteregion efter 3 års behandling. Ved en direkte sammenligning er det vist, at 1 års behandling med tablet alendronat a 70 mg ugentligt forårsager en større stigning i BMD i ryg og hofte end 1 års behandling med risedronat 35 mg per uge (4).
Virkningsmekanisme
Bisfosfonaterne virker antiresorptivt, idet de nedsætter osteoklastaktiviteten og dermed knogleomsætningen.
Behandlingsregimer
Perorale præparater kan administreres én gang om dagen eller én gang om ugen (alendronat og risedronat), én gang om måneden (ibandronat) eller cyklisk (etidronat). Som i.v.-infusion kan præparaterne indgives enten hver 3. måned (ibandronat og pamidronat) eller én gang om året (zoledronat). Ved peroral behandling bør ugentlig eller månedlig administration foretrækkes for at øge komplians. For alle bisfosfonater er absorptionen fra gastrointestinalkanalen særdeles ringe (<1%). Det er derfor af stor betydning, at patienter instrueres i at faste forud og 1 time efter tabletindtag. I.v.-infusion anvendes i de fleste tilfælde kun, når en patient ikke tåler peroral behandling, eller for at sikre komplians.
Behandlingsvarighed
Den optimale behandlingsvarighed for bisfosfonater kendes ikke. En pragmatisk holdning kan være at pausere alendronat efter 5 år hos patienter uden tidligere fraktur, hvis T-score er >-2,5. Man bør i disse tilfælde følge BMD hvert andet år og genoptage behandlingen ved faldende BMD. Der foreligger ikke tilsvarende data for de øvrige bisfosfonater, hvorfor behandlingspause med disse ikke hviler på evidensbaseret grundlag.
Bivirkninger
Gastrointestinale gener. Influenzalignede symptomer i form af hovedpine og smerter fra bevægeapparatet kan forekomme ved peroral behandling men forekommer hyppigere ved i.v.-infusion, hvor der også kan opstå febrilia af nogle dages varighed. Hyppigheden af de influenzalignede symptomer aftager ofte ved gentagne administrationer. Øjensymptomer i form af sclerit, episclerit og uveit samt aseptisk kæbenekrose er beskrevet i meget sjældne tilfælde hos patienter i osteoporosebehandling med bisfosfonater, men der er ikke dokumenteret en sikker årsagssammenhæng (5). Bisfosfonater udskilles renalt og bør ikke anvendes til patienter med svær nedsat nyrefunktion (creatinin clearence < 30 ml/min). Atypiske subtrochantære femur frakturer er yderst sjældne og risikoen for disse bivirkninger opvejes af den frakturforebyggende effekt.
Samlet vurdering
Bisfosfonater har en veldokumenteret effekt ved de fleste tilfælde af osteoporose, og har en acceptabel risikoprofil. Behandling med alendronat er veldokumenteret og relativt prisbilligt, hvorfor alendronat i mange tilfælde kan anbefales som førstevalgspræparat (Tabel 8).

9.2. Selektiv Estrogen Receptor Modulerende stoffer (SERM) (Baggrundsartikel: Raloxifen)
Raloxifen er godkendt til behandling af postmenopausal osteoporose. Raloxifen er i kliniske studier vist at kunne reducere forekomsten af vertebrale frakturer (Evidensniveau I) (6;7). Raloxifen er ikke vist at kunne reducere forekomsten af perifere frakturer (Tabel 8). Studiet blev efterfølgende forlænget til en samlet varighed af 8 år, hvor det viste sig at effekterne påvist efter 3 års behandling var stationære (8). Raloxifen reducerer desuden forekomsten af brystkræft med 76-90% (9). Der er ingen dokumenteret effekt på glukokortikoidinduceret osteoporose.
Virkningsmekanisme
SERMs er farmaka, der kan binde sig til østrogen receptor-a og/eller -b. Det er forskellen i affinitet for de to typer østrogen receptorer, der giver østrogen og de forskellige SERMs deres forskellige biologiske effekter. Raloxifenhydroklorid, der er et nonsteroidbenzothiofen, nedsætter knogleresorptionen via en hæmmende effekt på osteoklastrekruttering og aktivitet, i lighed med østrogen.
Bivirkninger
Hedeture, lægkramper, perifere ødemer og venøse tromboemboliske tilfælde (DVT) samt en øget risiko for et fatalt forløb ved cerebralt infarkt hos kvinder med hjerte-kar-sygdom eller risiko herfor (10).
 Samlet vurdering
Samlet vurdering
Ved samlet vurdering af fordele og risici ved behandling med raloxifen fandtes, at fordelene ved behandling med raloxifen overstiger risici (11). I en sammenlignende undersøgelse mellem raloxifen og alendronat, fandtes raloxifen at hæmme knogleomsætningen i mindre grad end alendronat og give en mindre stigning i BMD (12). På baggrund af dette studie, og da der ikke foreligger dokumentation for forebyggende effekt af raloxifen mod perifere frakturer herunder specielt hoftefrakturer, må raloxifen antages at være en lidt svagere antiresorptiv behandling end de kraftigst virkende bisfosfonater. Dette i kombination med en relativ høj behandlingspris gør, at raloxifen kun i udvalgte tilfælde kan anbefales som førstevalgspræparat.
Strontiumranelat er godkendt til behandling af postmenopausal osteoporose. Behandlingseffekten er dokumenteret for kvinder (Tabel 8). Tillige er der dokumenteret en antifraktureffekt specifikt hos kvinder ældre end 80 år (13). Der er dokumentation for effekt på BMD hos mænd men ikke hos patienter med sekundær osteoporose på baggrund af f.eks. glucokortikoidbehandling. I et Cochrane review blev det konkluderet, at 3 års behandling med strontiumranelat fører til en signifikant reduktion i risikoen for både kompressionsfrakturer i columna og perifere frakturer (Evidensniveau I) (14). Der er dokumentation for en vedvarende frakturreducerende effekt af 5 års behandling (15).
Effekter på BMD
Behandlingen fører til en markant (9-14%) stigning i BMD. En stor del af ændringen (50-75%) kan tilskrives, at strontium har en højere molekylvægt end kalcium, hvorfor indlejringen af strontium i knoglevævet fører til en større afsvækning af røntgenstrålerne ved en DXA-scanning, og dermed et højere estimat af BMD. Der kan korrigeres herfor ved at dividere den procentuelle stigning i BMD med en faktor 2-3. En stigning i BMD må forventes hos alle patienter (16). Hvis der ved en kontrolscanning findes et uændret/faldende BMD, bør det give anledning til en nærmere udredning af muligt behandlingssvigt (Afsnit 10.5). Der er dokumentation for, at stigningen i BMD korrelerer med en reduceret risiko for fraktur (17).
Virkningsmekanisme
Strontiums præcise virkningsmekanisme er ikke endeligt afklaret, men der er holdepunkter for, at strontium virker via calcium sensitive receptor (CaSR) eller via OPG/RANK/RANKL-systemet (18). Betegnelsen »dual acting drug« er blevet brugt om strontium, da nogle studier tyder på, strontium samtidigt stimulerer knogleformationen og hæmmer knogleresorptionen (19). Den kliniske betydning heraf er imidlertid fortsat uafklaret.
Behandlingsregime
Protelos® administreres som et granulat, der indeholder 2 gram strontiumranelat, som opslemmes i vand og indtages én gang dagligt. Det anbefales at tage Protelos® ved sengetid forudgået af 2 timers faste.
Bivirkninger
Kvalme, diarré. Forhøjet plasma-kreatinkinase. CNS-symptomer i form af hovedpine, hukommelsesbesvær, sedation og kramper. Øget risiko for dyb venetrombose. I meget sjældne tilfælde (1 ud af 35.000 behandlede) er der beskrevet en alvorlig allergisk reaktion i form af DRESS-syndrom (Drug Rash with Eosiophilic Systemic Symptom) som er opstået 3 og 6 uger efter behandlingens start med hududslæt ledsaget af feber, hævede kirtler og beskadigelse af lever og nyrer med døden til følge hos enkelte patienter.

Samlet vurdering
Strontiumranelat har en veldokumenteret anti-fraktureffekt hos postmenopausale kvinder. Det forhold at den daglige administration af medicinen skal forudgås af 2 timers faste, sammenholdt med en relativ høj behandlingspris, gør at Protelos® kun i udvalgte tilfælde kan anbefales som førstevalgspræparat.
Intakt parathyreoideahormon (PTH1-84) er markedsført under handelsnavnet Preotact®, mens PTH-analogen (PTH1-34), med det generiske navn teriparatid, forhandles under navnet Forsteo®. Behandling med begge præparater fører til en signifikant reduceret risiko for kompressionsfrakturer i columna, men kun teriparatid har dokumenteret effekt på perifere frakturer (Tabel 8) (20;21). Teriparatid har tillige dokumenteret effekt hos mænd (på BMD-niveau) og ved glukokortikoidinduceret osteoporose (22).
Effekter på BMD
18 måneders behandling fører til en markant stigning i BMD i såvel columna (7-10%) som i hofteregionen (2,1-2,5%).
Virkningsmekanisme
Intermitterende administration af PTH virker anabolt på knoglevæv, mens kontinuerlig forhøjet PTH, som ved primær hyperparathyreoidisme, fører til en katabol tilstand med udvikling af osteoporose. Forskellen i effekt som følge af kontinuerlig forhøjelse eller intermitterende administration er ikke endelig afklaret, men formodes at bero på forskellig genaktivering i de to situationer.
Behandlingsregime
Begge præparater administreres som én daglig subkutan injektion på hhv. 20 mikrogram teriparatid eller 100 mikrogram PTH. Injektionen foregår vha. en særlig injektionspen (i lighed med insulin). Behandlingen er begrænset til 18-24 måneder. Efter endt knogleanabolbehandling bør der efterfølgende gives behandling med et antiresorptiv middel. Ved skift fra antiresorptivt behandling kan behandling med teriparatid eller PTH iværksættes umiddelbart efter seponering af den antiresorptive behandling – men de 2 typer af behandling bør ikke gives samtidigt.
Indikation
Behandlingen kan kun iværksættes af speciallæge i endokrinologi, reumatologi, geriatri og/eller intern medicin. Kun patienter med sammenfald i columna kan få tilskud til behandlingen (Tabel 9).
Bivirkninger
Hyppige bivirkninger er palpitationer, svimmelhed, hovedpine og træthed. Disse kan ofte tilskrives hyperkalcæmi som også er en almindelig bivirkning. Ved hyperkalcæmi skal tilskud med kalciumpræparater primært seponeres. Ved fortsat hyperkalcæmi kan det forsøges kun at administrere medicinen hver anden dag. Mere sjældne bivirkninger inkluderer reaktioner på indstiksstedet, opkastning, dyspepsi, obstipation, diarré, smerter i ekstremiteter og knoglesmerter. Depression er en sjælden, men potentielt alvorlig bivirkning.
 Samlet vurdering
Samlet vurdering
Behandling med Forsteo® og Preotact® reducerer effektivt risikoen for kompressionsfrakturer i columna og bør overvejes som førstevalgsbehandling til patienter, som opfylder tilskudskriterierne.
Denosumab har dokumenteret effekt ved behandling af postmenopausal osteoporose hos kvinder samt hos mænd med c. prostatae og hypogonadisme som følge af medicinsk eller kirurgisk kastration (23). I forhold til placebo fører 3 års behandling af postmenopausale kvinder med osteoporose til at risikoen for fraktur mindskes signifikant med 68% i columna (RR 0,32; 95%KI 0,26 – 0,41) og med 40% i hofteregionen (RR 0,60; 95% KI 0,37 – 0,97)(24). Hos mænd med hypogonadisme mindsker denosumab risikoen for fraktur i columna med 62% (RR 0,38; 95% KI 0,19 – 0,78) (25).
Effekter på BMD
I forhold til placebo fører 3 års behandling med denosumab til at knoglemineraltætheden øges med 6-9%. I en randomiseret undersøgelse, som inkluderede postmenopausale kvinder med T-score ≤ -2,0, førte behandling med denosumab til et fald i koncentrationen af biokemiske knoglemarkører som var signifikant hurtigere indsættende end ved behandling med alendronat. I forhold til alendronat førte behandling med denosumab til, at BMD efter såvel ½ som 1 års behandling var signifikant øget med 0,6-1,1% på alle målesteder. Hos mænd medfører denosumab stigning i BMD.
Virkningsmekanisme
RANK-RANKL-OPG signalsystemet er af stor betydning for interaktionen mellem osteoklaster og osteoblaster. Osteoblastiske celler udtrykker både membranbundet og opløselig receptor aktivator af nukleare faktor-κB ligand (RANKL), der er et cytokin af betydning for osteoklasters dannelse, funktion og overlevelse. Når RANKL bindes til sin receptor (RANK), som findes på bl.a. multipotente celler fra makrofaglinien, stimuleres cellernes proliferation og uddifferentiering til osteoklaster. Osteoblaster secernerer tillige osteoprotegerin (OPG), der binder sig til og derved blokerer effekten af RANKL. Denosumab interagerer med denne proces gennem en OPG-lignede effekt, i det denosumab, som er et fuldt humant monoklonalt (IgG2) antistof, specifikt binder sig til og blokerer effekten af RANKL, hvorved der opnås en antiresorptiv effekt
Behandlingsregimer
Denosumab administreres subkutant i en dosis på 60 mg hver 6. måned. I modsætning til flere andre antiresorptivt virkende lægemidler som f.eks. bisfosfonater, deponeres denosumab ikke i knoglevævet og behandling med denosumab fører derfor ikke til en længerevarende antiresorptiv effekt. Ophør med behandlingen resulterer i en umiddelbar øget knogleomsætning med et hurtigt og markant fald i BMD på op til 5-7% i løbet af det første år efter ophørt behandling (27). Patienter som behandles med denosumab bør derfor informeres om at det er særdeles vigtigt at de overholder behandlingsregimet med injektioner hver 6. måned.
Bivirkninger
I overensstemmelse med en kraftig antiresorptiv virkning fører denosumab til at plasmakoncentrationen af PTH øges med en faktor 2-3 i ugerne efter indgift. I løbet af de efterfølgende måneder falder plasma PTH langsomt mod udgangsniveauet. Symptomgivende hypokalkæmi forekommer kun meget sjældent (28). Under behandling med denosumab, har den overordnede forekomst af bivirkninger været sammenlignelig med placebo. I de større studier er der ikke fundet en øget forekomst af neoplasier eller alvorlige infektioner, hvilket dog er tilfældet i 2 mindre studier. Et studium rapporterede flere hospitalskrævende infektioner hos patienter i denosumab (n=8 sv.t. 4,9%) i forhold til placebobehandling (n=1 sv.t. 0,6%) (29). I et andet studium så man alvorlige infektioner (n=3 sv.t. 1%) og neoplasier (n=6 sv.t. 1,6%) blandt 314 kvinder i behandling med denosumab mens lignende tilfælde ikke forekom hos 92 ikke-denosumab behandlede patienter (30). Da både T- og B lymfocytter har RANK-receptorer kan en immunsupprimerende virkning af denosumab ikke udelukkes, hvorfor det er vigtigt at være særlig opmærksom på disse forhold. Aseptisk kæbeknoglenekrose (osteonecrosis of the jaw) er ikke rapporteret hos osteoporose patienter i behandling med denosumab. Hos cancerpatienter med knoglemetastaser forekommer ONJ hos ca. 2% under behandling med denosumab, hvilket er sammenligneligt med hyppigheden ved behandling med zoledronsyre (31).
Denosumab elimineres i det reticulo-endotheliale system (RES), uafhængigt af nyrefunktionen. Principielt kan denosumab derfor anvendes hos patienter med nyrefunktionsnedsættelse. I en sub-analyse af ovennævnte studium hvor postmenopausale kvinder med osteoporose blev behandlet i 3 år med denosumab 24 var behandlingsresponset uafhængigt af nyrefunktionen. Studiet inkluderede kvinder med en en estimeret glomulær filtrations ratio (eGFR) på ned til 15 – 29 ml/min (32). Som udgangspunkt anbefales behandlingen dog ikke til patienter med eGFR < 30 ml/min pga en øget risiko for hypocalcæmi, ligesom tilstedeværelse af adynamisk knoglesygdom anses for at udgøre en kontraindikation til behandlingen.
Faktaboks 11. Denosumab (Prolia®) – særlige forholdsregler

Denosumab har en veldokumenteret frakturreducerende effekt ved de fleste former for osteoporose og har en acceptabel risikoprofil. Som ved andre nye lægemidler er der skærpet indberetningspligt, hvor alle eventuelle bivirkninger ved brugen skal indberettes til Lægemiddelstyrelsen. På grund af denosumabs mulige immunmodulerende effekter er der grund til at være særlig opmærksom på mulige bivirkninger i relation til immunsystemet. Der er forhåndenværende ikke dokumentation for brug af denosumab ved steroidinduceret osteoporose. Prismæssigt er behandling med denosumab på niveau med andre antiresorptive lægemidler, hvor der ikke er markedsført generika. Hos patienter, som ikke tåler behandling med alendronat, vil denosumab i mange tilfælde være et relevant 2. valgs præparat.Samlet vurdering
9.6. Andre midler mod osteoporose
Calcitonin
Calcitonin administreret som næsespray (Miacalcic®) er registreret til osteoporosebehandling. I 2 systematiske reviews baseret på randomiserede undersøgelser er det vist, at behandlingen reducere risikoen for kompressionsfrakturer i columna (33-34). Imidlertid var der et stort frafald (19-59 %) i de randomiserede undersøgelser, hvorfor resultaterne bør tolkes med forbehold (34). Calcitonin er ikke vist at mindske risikoen for perifere frakturer. Calcitonin kan ikke tilrådes som standardbehandling ved osteoporose.
Aktivt D-vitamin
D-vitamin-metabolitter, som er 1-a-hydroxyleret (f.eks. alfacalcidol), har formentlig en antifraktureffekt. I et systematisk review er behandlingen vist at reducere risikoen for komperssionsfrakturer i columna (RR 0,64, 95% KI 0,44-0,92), hvorimod der ikke kunne påvises effekt på risikoen for perifere frakturer (35). Behandling med 1-a-hydroxylerede D-vitamin-metabolitter kan overvejes hos patienter med spinal osteoporose, såfremt behandling med andre midler ikke kan gennemføres (f.eks. hos patienter med betydelig nedsat nyrefunktion). Pga. risiko for hyperkalcæmi bør serum-kalcium og nyrefunktion kontrolleres hver 3. måned.
Postmenopausal hormonsubstitution (HRT) (Baggrundsartikel: Østrogenbehandling)
Østrogen, evt. i kombination med et progesteron, har tidligere været anvendt i stort omfang til behandling af postmenopausal osteoporose. Flere systematiske reviews har dokumenteret, at HRT øger BMD og reducerer risikoen for såvel kompressionsfrakturer i columna som risikoen for perifere frakturer (Evidensniveau I) (36). Bivirkningerne i form af brystkræft, blodpropper i hjerte, hjerne og dybe vener er dog så alvorlige, at præparaterne ikke længere kan anbefales til behandling af osteoporose hos postmenopausale kvinder (37). Dog bør yngre kvinder med primær eller sekundær amenoré behandles med HRT frem til det forventede menopausetidspunkt.
Testosteron (Baggrundsartikel: Testosteron)
Kan anvendes til mænd med hypogonadisme (Afsnit 10.4).
Andre lægemidler
Behandling med thiaziddiuretika er i flere randomiserede studier vist at kunne øge BMD, og i overensstemmelse hermed har observationelle studier vist, at risikoen for fraktur er mindsket med 10- 20% hos patienter i behandling med thiazider (28;29). Da der imidlertid ikke foreligger randomiserede kontrollerede studier med fraktur som endemål, kan thiaziddiuretika ikke anbefales som osteoporosebehandling. Ligeledes kan flourid ikke anbefales til behandling af osteoporose, da de foreliggende studier ikke har vist en overbevisende frakturreducerende effekt (30).
Strontiumranelat er godkendt til behandling af postmenopausal osteoporose. Behandlingseffekten er dokumenteret for kvinder (Tabel 8). Tillige er der dokumenteret en antifraktureffekt specifikt hos kvinder ældre end 80 år (13). Der er ingen dokumentation for effekt hos mænd eller hos patienter med sekundær osteoporose på baggrund af f.eks. glucokortikoidbehandling.
Tabel 8. Dokumenteret effekt på risiko for fraktur af lægemidler som har opnået markedsføringstilladelse til behandling af osteoporose
 Tabel 9. Kriterier per 1.02.09 for tildeling af enkelttilskud til knogleanabol behandling med enten Preotact® eller Fosteo®. Pga. en høj behandlingspris bør der samtidigt ansøges om knonikertilskud.
Tabel 9. Kriterier per 1.02.09 for tildeling af enkelttilskud til knogleanabol behandling med enten Preotact® eller Fosteo®. Pga. en høj behandlingspris bør der samtidigt ansøges om knonikertilskud.
 Referenceliste
Referenceliste
1. Cranney A, Wells G, Willan A, Griffith L, Zytaruk N, Robinson V et al. II. Meta-Analysis of Alendronate for the Treatment of Postmenopausal Women. Endocr Rev 2002; 23:508-516. [Medline]
2. Cranney A, Tugwell P, Adachi J, Weaver B, Zytaruk N, Papaioannou A et al. III. Meta-Analysis of Risedronate for the Treatment of Postmenopausal Osteoporosis. Endocr Rev 2002; 23:517-523. [Medline]
3. Lyles KW, Colon-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C et al. Zoledronic Acid and Clinical Fractures and Mortality after Hip Fracture. N Engl J Med 2007;NEJMoa074941. [Medline]
4. Rosen CJ, Hochberg MC, Bonnick SL, McClung M, Miller P, Broy S et al. Treatment With Once-Weekly Alendronate 70 mg Compared With Once-Weekly Risedronate 35 mg in Women With Postmenopausal Osteoporosis: A Randomized Double-Blind Study. Journal of Bone and Mineral Research 2005; 20:141-151. [Medline]
5. Khosla S, Burr D, Cauley J, Dempster DW, Ebeling PR, Felsenberg D et al. Bisphosphonate-Associated Osteonecrosis of the Jaw: Report of a Task Force of the American Society for Bone and Mineral Research. Journal of Bone and Mineral Research 2000; 0:1-45. [Medline]
6. Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 1999; 282:637-645. [Medline]
7. Cranney A, Tugwell P, Zytaruk N, Robinson V, Weaver B, Adachi J et al. IV. Meta-Analysis of Raloxifene for the Prevention and Treatment of Postmenopausal Osteoporosis. Endocr Rev 2002; 23:524-528. [Medline]
8. Siris ES, Harris ST, Eastell R, Zanchetta JR, Goemaere S, Diez-Perez A et al. Skeletal Effects of Raloxifene After 8 Years: Results from the Continuing Outcomes Relevant to Evista (CORE) Study. Journal of Bone and Mineral Research 2005; 20:1514-1524. [Medline]
9. Cummings SR, Eckert S, Krueger KA, Grady D, Powles TJ, Cauley JA et al. The Effect of Raloxifene on Risk of Breast Cancer in Postmenopausal Women: Results From the MORE Randomized Trial. JAMA: The Journal of the American Medical Association 1999; 281:2189-2197. [Medline]
10. Barrett-Connor E, Mosca L, Collins P, Geiger MJ, Grady D, Kornitzer M et al. Effects of Raloxifene on Cardiovascular Events and Breast Cancer in Postmenopausal Women. N Engl J Med 2006; 355:125-137. [Medline]
11. Barrett-Connor E, Cauley JA, Kulkarni PM, Sashegyi A, Cox DA, Geiger MJ. Risk-Benefit Profile for Raloxifene: 4-Year Data From the Multiple Outcomes of Raloxifene Evaluation (MORE) Randomized Trial. Journal of Bone and Mineral Research 2004; 19:1270-1275. [Medline]
12. Sambrook PN, Geusens P, Ribot C, Solimano JA, Ferrer-Barriendos J, Gaines K et al. Alendronate produces greater effects than raloxifene on bone density and bone turnover in postmenopausal women with low bone density: results of EFFECT (Efficacy of FOSAMAX versus EVISTA Comparison Trial) International. J Intern Med 2004; 255:503-511. [Medline]
13. Seeman E, Vellas B, Benhamou C, Aquino JP, Semler J, Kaufman JM et al. Strontium ranelate reduces the risk of vertebral and nonvertebral fractures in women eighty years of age and older. J Bone Miner Res 2006; 21:1113-1120. [Medline]
14. O’Donnell S, Cranney A, Wells GA, Adachi JD, Reginster JY. Strontium ranelate for preventing and treating postmenopausal osteoporosis. Cochrane Database Syst Rev 2006; 3:CD005326. [Medline]
15. Roux C. Strontium ranelate: short- and long-term benefits for post-menopausal women with osteoporosis. Rheumatology 2008; 47:iv20-iv22. [Medline]
16. Blake GM, Lewiecki EM, Kendler DL, Fogelman I. A Review of Strontium Ranelate and Its Effect on DXA Scans. Journal of Clinical Densitometry 2007; 10:113-119. [Medline]
17. Bruyere O, Roux C, Detilleux J, Slosman DO, Spector TD, Fardellone P et al. Relationship between bone mineral density changes and fracture risk reduction in patients treated with strontium ranelate. J Clin Endocrinol Metab 2007; 92:3076-3081. [Medline]
18. Chattopadhyay N, Quinn SJ, Kifor O, Ye C, Brown EM. The calcium-sensing receptor (CaR) is involved in strontium ranelate-induced osteoblast proliferation. Biochem Pharmacol 2007; 74:438-447. [Medline]
19. Marie PJ, Ammann P, Boivin G, Rey C. Mechanisms of Action and Therapeutic Potential of Strontium in Bone. Calcified Tissue International 2001; 69:121-129. [Medline]
20. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344:1434-1441. [Medline]
21. Greenspan SL, Bone HG, Ettinger MP, Hanley DA, Lindsay R, Zanchetta JR et al. Effect of Recombinant Human Parathyroid Hormone (1-84) on Vertebral Fracture and Bone Mineral Density in Postmenopausal Women with Osteoporosis: A Randomized Trial. Ann Intern Med 2007; 146:326-339. [Medline]
22. Orwoll ES, Scheele WH, Paul S, Adami S, Syversen U, Diez-Perez A et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res 2003; 18:9-17. [Medline]
23. Rejnmark L, Vestergaard P, Mosekilde L. Denosumab er en ny effektiv osteoporosebehandling. Ugeskr.Laeger 2011;173(5):346-9.
24. Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009;361(8):756-65.
25. Smith MR, Egerdie B, Toriz NH, Feldman R, Tammela TLJ, Saad F et al. Denosumab in Men Receiving Androgen-Deprivation Therapy for Prostate Cancer. N Engl J Med 2009;361(8):745-55.
26. Brown JP, Prince RL, Deal C, Recker RR, Kiel DP, de Gregorio LH et al. Comparison of the Effect of Denosumab and Alendronate on BMD and Biochemical Markers of Bone Turnover in Postmenopausal Women With Low Bone Mass: A Randomized, Blinded, Phase 3 Trial*. Journal of Bone and Mineral Research 2009;24(1):153-61.
27. Miller PD, Bolognese MA, Lewiecki EM, McClung MR, Ding B, Austin M et al. Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: A randomized blinded phase 2 clinical trial. Bone 2008;43(2):222-9.
28. Bekker PJ, Holloway DL, Rasmussen AS, Murphy R, Martin SW, Leese PT et al. A single-dose placebo-controlled study of AMG 162, a fully human monoclonal antibody to RANKL, in postmenopausal women. J Bone Miner.Res. 2004;19(7):1059-66.
29. Bone HG, Bolognese MA, Yuen CK, Kendler DL, Wang H, Liu Y et al. Effects of Denosumab on Bone Mineral Density and Bone Turnover in Postmenopausal Women. Journal of Clinical Endocrinology Metabolism 2008;93(6):2149-57.
30. McClung MR, Lewiecki EM, Cohen SB, Bolognese MA, Woodson GC, Moffett AH et al. Denosumab in Postmenopausal Women with Low Bone Mineral Density. N Engl J Med;354(8):821-31.
31. Kyrgidis A, Toulis K. Denosumab-related osteonecrosis of the jaws. Osteoporosis International. 2011 Jan;22(1):369-70. Epub 2010 Mar 20. Medline
32. Jamal SA, Ljunggren O, Stehman-Breen C, Cummings SR, McClung MR, Goemaere S et al. The effects of denosumab on fracture and bone mineral density by level of kidney function. Journal of Bone and Mineral Research 2011;26(8):1829-35.
33. Hauselmann HJ, Rizzoli R. A comprehensive review of treatments for postmenopausal osteoporosis. Osteoporos Int 2003; 14:2-12. [Medline]
34. Cranney A, Tugwell P, Zytaruk N, Robinson V, Weaver B, Shea B et al. VI. Meta-Analysis of Calcitonin for the Treatment of Postmenopausal Osteoporosis. Endocr Rev 2002; 23:540-551. [Medline]
35. Papadimitropoulos E, Wells G, Shea B, Gillespie W, Weaver B, Zytaruk N et al. VIII: Meta-Analysis of the Efficacy of Vitamin D Treatment in Preventing Osteoporosis in Postmenopausal Women. Endocr Rev 2002; 23:560-569. [Medline]
36. Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of nonvertebral fractures: a meta-analysis of randomized trials. JAMA 2001; 285:2891-2897. [Medline]
37. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288:321-333. [Medline]
38. LaCroix AZ, Ott SM, Ichikawa L, Scholes D, Barlow WE. Low-dose hydrochlorothiazide and preservation of bone mineral density in older adults. A randomized, double-blind, placebo-controlled trial. Ann Intern Med 2000; 133:516-526. [Medline]
39. Rejnmark L, Vestergaard P, Mosekilde L. Reduced fracture risk in users of thiazide diuretics. Calcif Tissue Int 2005; 76:167-175. [Medline]
40. Vestergaard P, Jorgensen NR, Schwarz P, Mosekilde L. Effects of treatment with fluoride on bone mineral density and fracture risk – a meta-analysis. Osteoporos Int 2008; 19:257-268. [Medline]



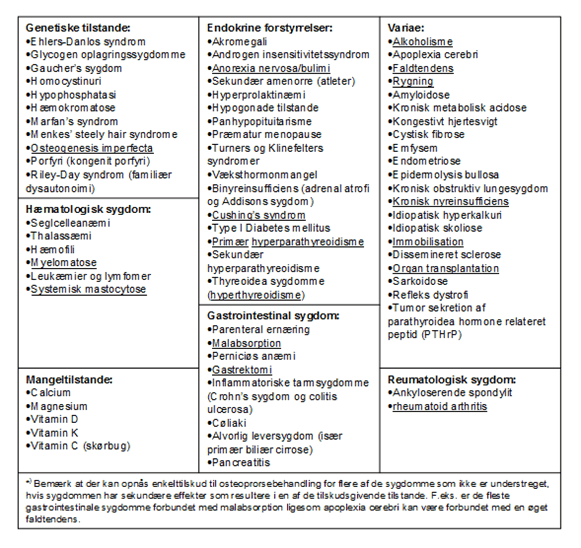
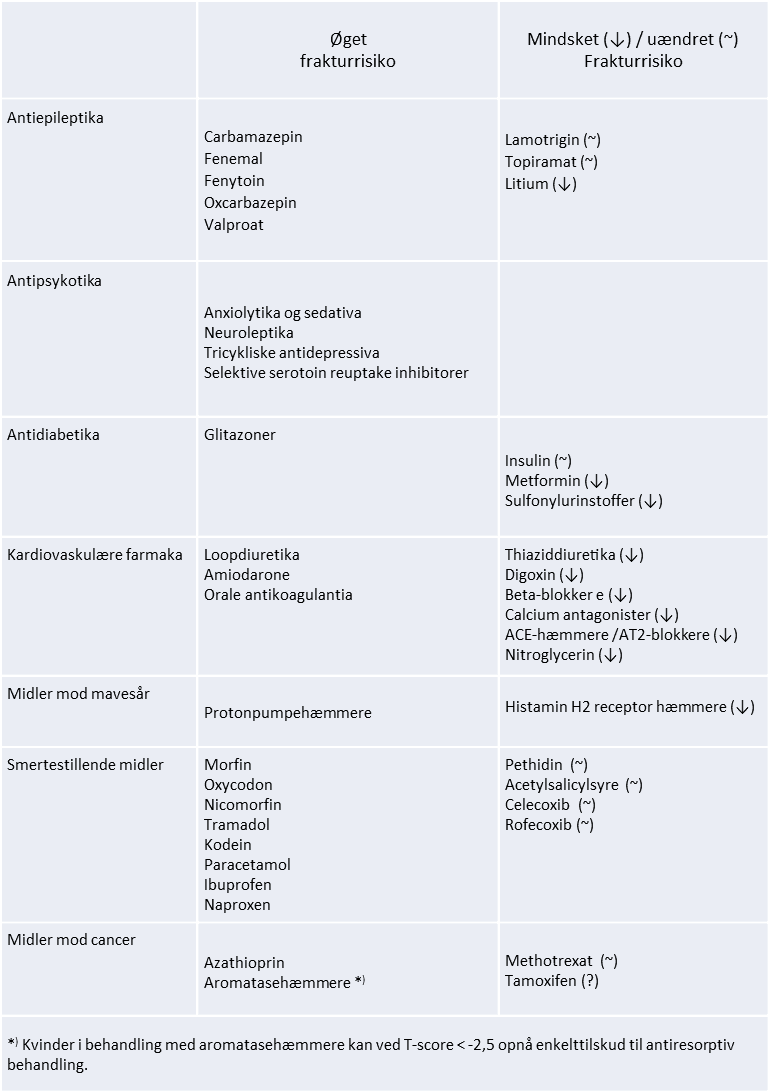


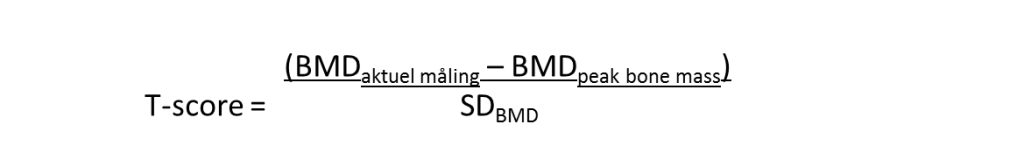







 Beregning af dagligt kalkindtag er
Beregning af dagligt kalkindtag er

 Samlet vurdering
Samlet vurdering
 Samlet vurdering
Samlet vurdering
 Tabel 9. Kriterier per 1.02.09 for tildeling af enkelttilskud til knogleanabol behandling med enten Preotact® eller Fosteo®. Pga. en høj behandlingspris bør der samtidigt ansøges om knonikertilskud.
Tabel 9. Kriterier per 1.02.09 for tildeling af enkelttilskud til knogleanabol behandling med enten Preotact® eller Fosteo®. Pga. en høj behandlingspris bør der samtidigt ansøges om knonikertilskud. Referenceliste
Referenceliste

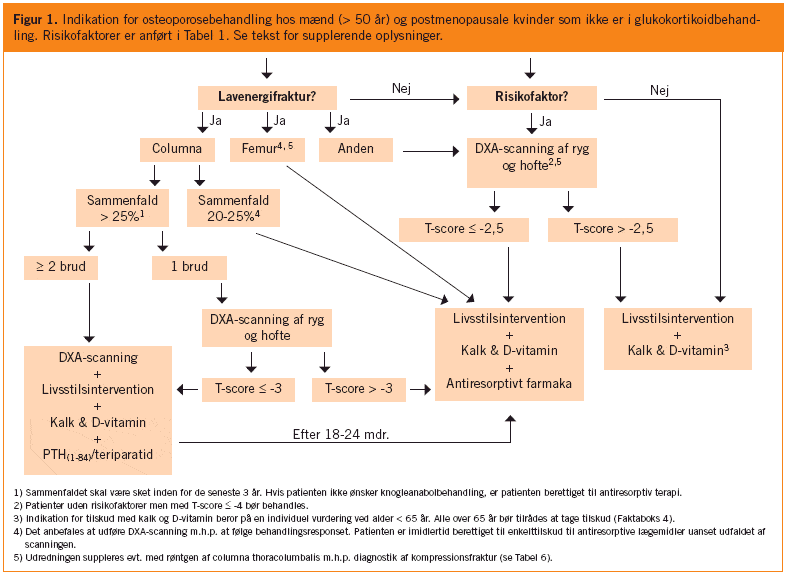

 Referenceliste
Referenceliste